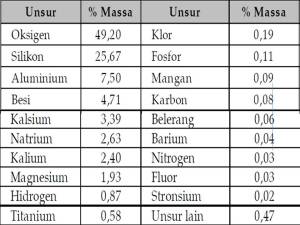
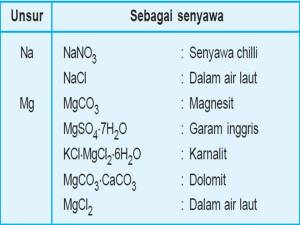
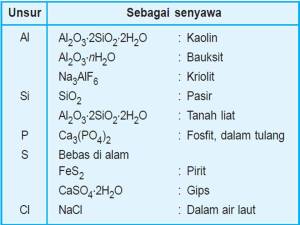
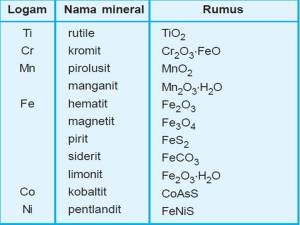
- Kelimpahan unsur di alam
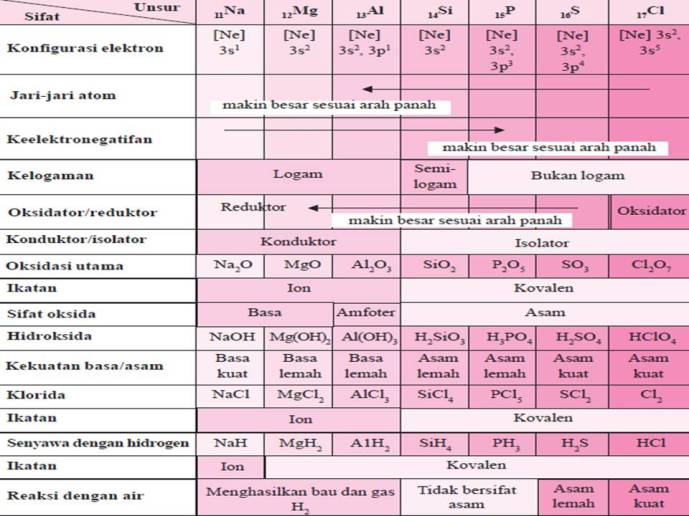
- Sifat fisis dan sifat kimia unsur-unsur gas mulia, halogen, alkali, alkali tanah, periode 3 dan periode 4
1. KALZIUM
Apa itu kalzium??? Mungkin yang terlintas di pikiran kalian kalzium adalah unsur dalam sistem periodik unsur yang biasa disimbolkan dengan lambang Ca bukan??? Kalau benar begitu, anda salah :D
Kalzium adalah nama sebuah software (open source software - OSS) yang memanfaatkan tabel periodik untuk mengeksplorasi setiap unsur. Tapi ternyata tidak sekedar tabel periodik biasa, lebih dari sekedar tabel periodik. Kalzium berasal dari bahasa Jerman dari kata kalsium. Saat ini Kalzium sampai di versi Hidrogen. Untuk diketahui semenjak Kalzium menjadi aplikasi standalone ia versinya akan dinamai dengan urutan nama unsur dalam tabel periodik.
Nah pada kesempatan ini saya akan memberikan sedikit informasi tentang apa sih kalzium itu dan apa sih gunanya??? Sebelum itu, cara mendapatkan aplikasi ini sangat mudah, seperti yang sudah saya tulisakan tentang ”Cara mengintall aplikasi kimia pada linux”. Tentunya temen-temen sudah baca kan caranya???
Oke langsung saja...
Setelah diinstall, saat temen-temen buka aplikasi kalzium, kalian akan mendapatkan tampilan seperti di bawah ini.
Pada pojok kiri atas terdapat menu untuk merubah bentuk SPU, kita bisa merubahnya sesuai dengan keinginan kita, bentuk SPU pendek, panjang atau yang lain. Tampilan yang saya sajikan diatas adalah jenis SPU pendek.
Untuk bentuk SPU yang lain bisa dilihat pada gambar berikut ini :
- Bentuk SPU panjang
- Bentuk SPU klasik

- Transition Elements

- DZ Periodic Table
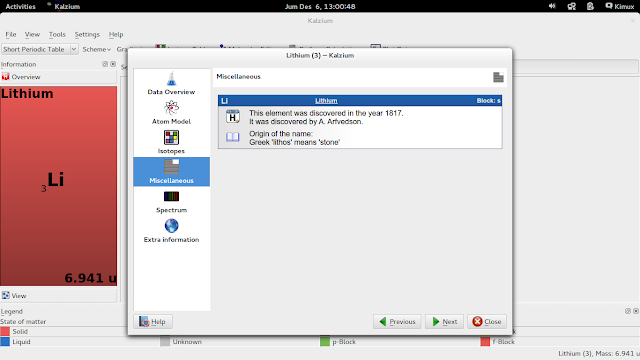
Lalu apabila kita meng-klik salah satu unsur, maka aplikasi ini akan memberikan informasi kepada kita tentang unsur tersebut. Misal kita meng-klik unsur Li, maka akan muncul informasi mengenai unsur tersebut (misal titik leleh, titik didih, afinitas elektron, dll) seperti yang terdapat pada tampilan berikut :
Software ini sangat cocok untuk materi yang tersebut di atas, karena bisa menampilkan sifat fisis dan sifat kimia dari berbagai macam unsur.
2. GPeriodic
Pada dasarnya aplikasi ini sama seperti kalzium yang berupa sistem periodik unsur. Namun aplikasi ini hanya berfungsi untuk memaparkan informasi dari unsur-unsur. Tidak seperti kalzium yang sudah dilengkapi dengan menu lain yang lengkap, seperti Isotope Table, Molecular Editor, Perform Calculations, dll.
Tampilan dari aplikasi ini adalah sebagai berikut :
Apabila kita meng-klik salah satu unsur, maka akan muncul informasi mengenai unsur tersebut seperti nama unsur, simbol, nomor atom, massa jenis, titik leleh, titik didih, dll. Sebagai contoh, apabila kita meng-klik unsur Ca maka akan muncul informasi mengenai unsur Ca, seperti pada tampilan berikut :
3. Periodic Table
Aplikasi ini sama seperti aplikasi yang sudah saya sebutkan diatas yaitu berupa sistem periodik unsur yang dapat memunculkan informasi setiap unsur. Tampilan dari aplikasi ini adalah sebagai berikut :
Apabila kita meng-klik salah satu unsur, sebagai contoh adalah unsur Ca, maka akan muncul tampilan sebagai berikut :
4. Periodic table of the elements
Aplikasi ini juga sama seperti yang sudah saya sebutkan diatas, yaitu berupa sistem periodik unsur. Hanya berbeda pada tampilannya saja.
Beginilah tampilan dari aplikasi ini :
Apabila kita meng-klik salah satu unsur, maka akan muncul tampilan sebagai berikut :
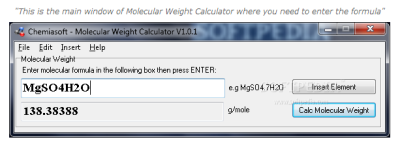
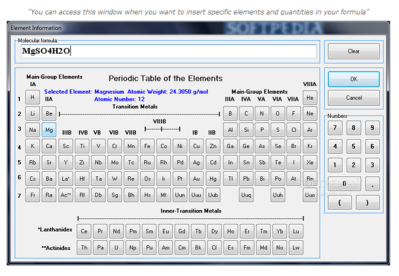
Molecular Weight Calculator ini digunakan untuk menghitung berat dari suatu molekul. Aplikasi ini akan memungkinkan Anda untuk melakukan perhitungan berat molekul dari setiap rumus kimia. Berkaitan dengan perhitungan massa pada materi konsep mol. Hal ini mudah digunakan dan akurat, mengandung tabel periodik tertanam dalam bentuk elements insert mudah dari tabel periodik. Aplikasi ini cocok untuk mahasiswa, ahli kimia, ilmuwan, guru dan analis.
Berikut adalah beberapa fitur kunci dari “Molecular Weight Calculator 1.0.1″ :
- Mudah digunakan sebagai kalkulator molekul
- Menghitung berat molekul atau massa molar dari setiap rumus kimia
- Memasukkan unsur-unsur dari tabel periodik yang tertanam
Berikut ini adalah platform dari Molecular Weight Calculator 1.0.1
6. Chemix School
7. Software Sistem Periodik Unsur (Kimia)
Di kelas sering kali guru kimia merasa kesulitan dalam melakukan visualisasi terhadap sifat-sifat unsur serta kecenderungannya dalam Sistem periodik Unsur, pada umumnya yang dilakukan adalah dengan meng-convert harga sifat-sifat keperiodikan dalam tabel, yang kemudian disampaikan kepada siswa, permasalahan yang dihadapi adalah bahwa dalam proses tersebut tidak semua guru dapat mempresesntasikan kecenderungan tersebut dengan baik dalam bentuk tabel, hingga pada akhirnya ditempuh jalan yang paling mudah yaitu dengan menghafalkan kecenderungan sifat keperidikan dalam satu golongan dan satu periode yang kemudian menggeneralisasikan untuk golongan dan periode yang lain.
Terdapat beberapa kelebihan dari software ini dari kesempatan mencoba, yaitu :
1. Ukuran file instalasi yang relatif kecil yang hanya 5,3 M (seukuran dengan 1 file lagu MP3).
2. Penggunaan yang mudah dengan Navigasi dan Ikon yang jelas.
3. Ikon-ikon utama yang memudahkan kita untuk :
- melihat SPU secara keseluruhan
- melihat grafik kecenderungan sifat keperiodikan unsur.
- Ikon Seacrh yang memungkinkan kita melakukan pencarian terhadap suatu unsur
- Ikon komparasi data jari-jari atom dari 2 unsur yang berbeda
- Simulasi dari Konfigurasi elektron dari unsur yang diinginkan
Disamping hal tersebut terdapat juga jendela yang memungkinakn kita untuk memahami lebih jauh dari unsur yang kita inginkan lengkap dengan navigasi seperti pada sebuah browser. Dijendela ini anda dapat mendapatkan informasi lebih tentang sifat-sifat fisika dan kimia, cerita tentang penemuan hingga kegunaan dari unsur tersebut. dan Jika anda terkoneksi dengan internet maka anda bisa mendapatkan add on yang menarik dari progam ini seperti quiz dan sebagainya.
8. GElement (Program Kimia ChemPup)
GElement merupakan salah satu perangkat lunak yang di "bundle" bersama chempup. Software ini adalah tabel periodik unsur yang memiliki informasi dari setiap unsur yang disajikan. Salah satu kelebihan software ini adalah kita bisa mendapatkan informasi yang sangat banyak dari masing-masing unsur. Kita bisa mendapatkan informasi umum mengenai unsur tersebut semisal kaum, periode, penemu dan tempat ditemukannya, lalu kita juga bisa mengetahui sifat fisik dan atom dari unsur. Satu hal lagi yang menarik dari software ini kita dapat mengurutkan unsur-unsur yang ada di tabel periodik sesuai dengan keinginan kita yaitu dengan mengubah sudut pandangnya menjadi bentuk tabel.
GElement sebenarnya merupakan aplikasi yang dapat dipasang pada setiap sistem operasi Linux. Menurut saya GElement atau dengan nama sedikit beda GElemental namun tampilannya lebih bagus.
Tapi kali ini saya membahasannya setelah saya mencoba menggunakan ChemPup dalam Puppy Linux. Seperti halnya aplikasi yang menyajikan tabel periodik tentu akan memberikan informasi sedatail mungkin dengan tampilan yang sangat menarik. Tak terlalu banyak lebih-nya pada aplikasi yang satu ini.
Pada GElement ini kita bisa melihat properti terkait unsur masing-masing mulai dari informasi yang tergolong umum, sifat fisik, maupun sifat atomiknya.
Dari tabel ini kita juga bisa menelusuri lebih lanjut mengenai sumber yang dijadikan patokan pemberian nilai-nilai variabel sifat.
Sumber :
http://urip.wordpress.com/
Semoga bermanfaat...Amin :)